厚生労働省の薬事行政を所掌範囲とする薬事分科会には大変たくさんの下部部会が存在しており、専門家以外の方には(専門家でも?)さっくり把握するのも難しいほど広い組織体系となっています。
特に紛らわしいのが、「医薬品第一部会」と「医薬品第二部会」。
この名が体を現さない(名前だけでは内容の違いを判別することのできない)2つの部会の違いを調べてみたところ、部会における審議機能の差異というより、むしろ取り扱う医薬品領域によって分別されることが分かりました。
簡単に言えば、「第二部会」は扱う分野が明示的に指定されているようです。

以下、その根拠を詳しく見てみましょう。
薬事食品衛生審議会
早速、「医薬品第一部会」と「医薬品第二部会」の位置取りですが、以下のようになっています。
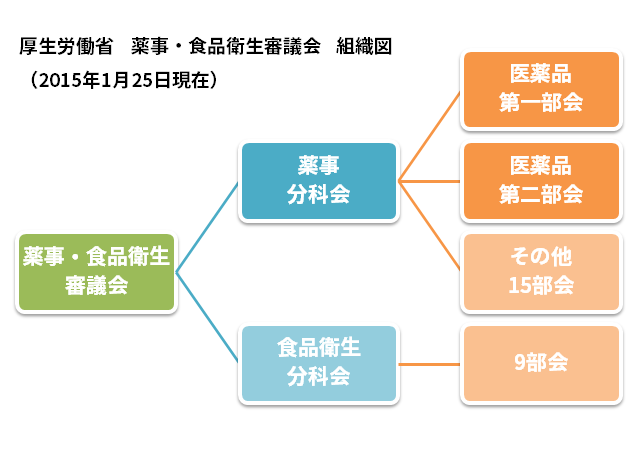
まず注目すべきは「薬事食品衛生審議会」、通称「薬食審(やくしょくしん)」。
「薬事食品衛生審議会」は厚生労働省に設置された審議会の一つで、厚生労働省設置法をその法的根拠としています。
また薬事・食品衛生審議会令に規定された「薬事分科会」および「食品衛生分科会」の各分科会が審議会の下に設置され、今回話題としている「医薬品第一部会・第二部会」は「薬事分科会」のさらに下に設置された、いわば実働部会に当たります。
参照:平成27年1月26日 薬事・食品衛生審議会 総会資料 資料1 薬事・食品衛生審議会組織図
薬事分科会
薬食審の筆頭分科会ともいえる薬事分科会の組織は薬事分科会規程に示されています。
(部会の設置)
第2条 分科会に次に掲げる部会を置く。
- 一 日本薬局方部会
- 二 副作用・感染等被害判定第一部会
- 三 副作用・感染等被害判定第二部会
- 四 医薬品第一部会
- 五 医薬品第二部会
- 六 血液事業部会
- 七 医療機器・体外診断薬部会
- 八 医薬品再評価部会
- 九 再生医療等製品・生物由来技術部会
- 十 要指導・一般用医薬品部会
- 十一 化粧品・医薬部外品部会
- 十二 医薬品等安全対策部会
- 十三 医療機器・再生医療等製品安全対策部会
- 十四 指定薬物部会
- 十五 毒物劇物部会
- 十六 化学物質安全対策部会
- 十七 動物用医薬品等部会
「副作用・感染等被害判定第一部会」および「(同)第二部会」なるものもありますが、ここでは「四 医薬品第一部会」および「五 医薬品第二部会」のみに話題を絞りましょう。
参照:平成28年2月24日 薬事分科会審議参加規程評価委員薬事分科会 参考資料2 薬事分科会規程
医薬品部会のお仕事
ところで、医薬品部会とは一体、具体的に何をやってるところなの?
というわけで、PMDA(独立行政法人 医薬品医療機器総合機構)のサイトから図を引用してみます。元画像は細かすぎるため、ここでは簡略図を作成しました。
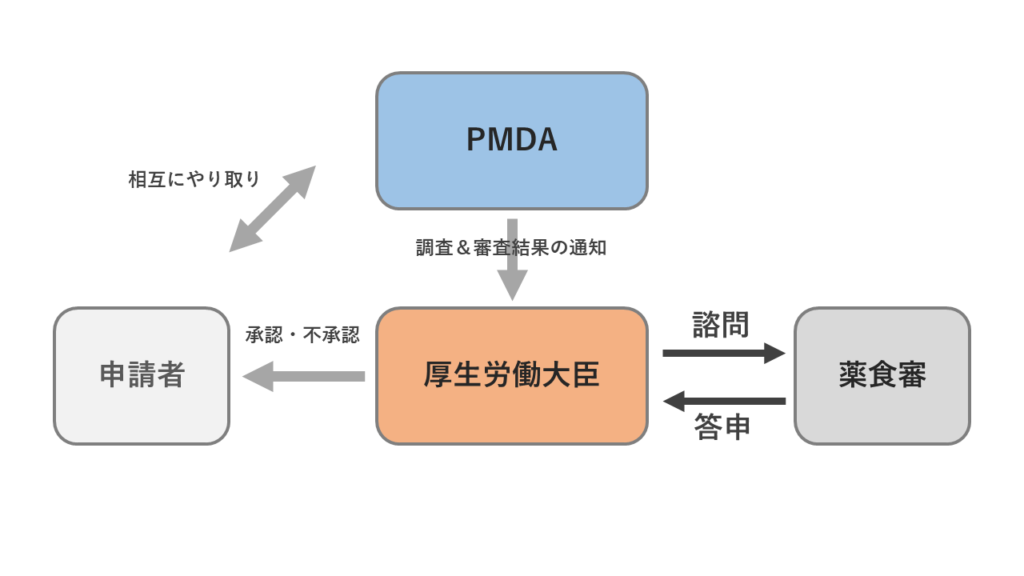
新規医薬品の承認審査業務を示す元図の右下に当たる部分、PMDAの審査結果が出た後の最終段階で外部専門家集団たる「薬事・食品衛生審議会」に諮問されますが、これはそのまま「薬事分科会」、「医薬品部会」へと案件が回ってくるので、これを処理したのち、厚生労働省へ答申を返すのが具体的な役割となります。
したがって、医薬品部会は、その承認が厚生労働大臣の承認と基本的にほぼ等価となる大変重い責務を担っています。
2部会の比較
さて、そんな医薬品部会の「第一部会」と「第二部会」の具体的な差異について根拠に基づき眺めてみましょう。
医薬品第一部会
「医薬品第一部会」は薬事分科会規程第3条4に規定されます。
4
医薬品第一部会は、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(昭和35年法律第145号。以下「法」という。)第2条第10項の規定による生物由来製品の指定及び同条第11項の規定による特定生物由来製品の指定に関する事項、第14条第8項(同条第9項、法第19条の2第5項において準用する場合を含む。以下同じ。)の規定による新医薬品の承認に関する事項、法第14条の4第1項第1号イ及びロ並びに第2項の規定による新医薬品の再審査に係る調査期間の指定及び延長に関する事項、法第42条第1項の規定による医薬品の基準に関する事項、法第44条第1項に規定する毒薬の指定及び同条第2項に規定する劇薬の指定に関する事項並びに法第77条の2第1項の規定による希少疾病用医薬品の指定に関する事項を調査審議する(他の部会に属する事項を除く。)。
「規定」に関する記載を省略してみれば、
医薬品第一部会は、生物由来製品の指定及び特定生物由来製品の指定に関する事項、新医薬品の承認に関する事項、新医薬品の再審査に係る調査期間の指定及び延長に関する事項、医薬品の基準に関する事項、毒薬の指定及び劇薬の指定に関する事項並びに希少疾病用医薬品の指定に関する事項を調査審議する(他の部会に属する事項を除く。)。
となりますね。箇条書きにしてみますと、
- 生物由来製品の指定及び特定生物由来製品の指定に関する事項
- 新医薬品の承認に関する事項
- 新医薬品の再審査に係る調査期間の指定及び延長に関する事項
- 医薬品の基準に関する事項
- 毒薬の指定及び劇薬の指定に関する事項並びに希少疾病用医薬品の指定に関する事項
といった風になります。
医薬品第二部会
「医薬品第二部会」は薬事分科会規程第3条5に規定されます。
5
医薬品第二部会は、法第2条第10項の規定による生物由来製品(次の各号に掲げるものに限る。)の指定及び同条第11項の規定による特定生物由来製品(次の各号に掲げるものに限る。)の指定に関する事項、法第14条第8項の規定による医療用の新医薬品(次の各号に掲げるものに限る。以下この項において同じ。)の承認に関する事項、法第 14 条の4第1項第1号イ及びロ並びに第2項の規定による新医薬品の再審査に係る調査期間の指定及び延長に関する事項、法第42条第1項の規定による医薬品の基準に関する事項(法第68条の19において準用する法第42条第1項の規定による生物由来原料基準(平成15年5月厚生労働省告示第210号)通則(血液製剤に係るものに限る。)及び血液製剤総則を含む。第9項において「血液製剤基準」という。)、法第44条第1項に規定する毒薬の指定及び同条第2項に規定する劇薬の指定に関する事項並びに法第 77 条の2第1項の規定による希少疾病用医薬品の指定に関する事項を調査審議する。
一 抗菌性物質製剤
二 化学療法剤
三 抗悪性腫瘍剤
四 血液製剤
五 生物学的製剤
六 呼吸器官用薬
七 アレルギー用薬(外用剤を除く。)
八 感覚器官用薬(炎症性疾患に対するものに限る。)
九 放射性医薬品(第一号から第八号までに掲げる医薬品の対象疾患に対する診断を目的とするものに限る。)
十 診断用薬(体外診断用医薬品を除く。)(第一号から第八号までに掲げる医薬品の対象疾患に対する診断を目的とするものに限る。)
例によって「規定」を省略。
医薬品第二部会は、生物由来製品(次の各号に掲げるものに限る。)の指定及び特定生物由来製品(次の各号に掲げるものに限る。)の指定に関する事項、医療用の新医薬品(次の各号に掲げるものに限る。以下この項において同じ。)の承認に関する事項、新医薬品の再審査に係る調査期間の指定及び延長に関する事項、医薬品の基準に関する事項(生物由来原料基準通則(血液製剤に係るものに限る。)及び血液製剤総則を含む。第9項において「血液製剤基準」という。)、毒薬の指定及び劇薬の指定に関する事項並びに希少疾病用医薬品の指定に関する事項を調査審議する。
意味が通らないものも出てきましたが、取り敢えず箇条書きしてみましょう。
- 生物由来製品(次の各号に掲げるものに限る。)の指定及び特定生物由来製品(次の各号に掲げるものに限る。)の指定に関する事項
- 医療用の新医薬品(次の各号に掲げるものに限る。以下この項において同じ。)の承認に関する事項
- 新医薬品の再審査に係る調査期間の指定及び延長に関する事項
- 医薬品の基準に関する事項(生物由来原料基準通則(血液製剤に係るものに限る。)及び血液製剤総則を含む。第9項において「血液製剤基準」という。)
- 毒薬の指定及び劇薬の指定に関する事項並びに希少疾病用医薬品の指定に関する事項
第二部会=ホワイトリスト
上記2部会の箇条書き部分を比較してみれば、ほとんど同じことが書かれています。最大の違いは、第二部会のみに記される次の1点。
(次の各号に掲げるものに限る。)
すなわち、
- 一 抗菌性物質製剤
- 二 化学療法剤
- 三 抗悪性腫瘍剤
- 四 血液製剤
- 五 生物学的製剤
- 六 呼吸器官用薬
- 七 アレルギー用薬(外用剤を除く。)
- 八 感覚器官用薬(炎症性疾患に対するものに限る。)
- 九 放射性医薬品(第一号から第八号までに掲げる医薬品の対象疾患に対する診断を目的とするものに限る。)
- 十 診断用薬(体外診断用医薬品を除く。)(第一号から第八号までに掲げる医薬品の対象疾患に対する診断を目的とするものに限る。)
このリストに載るものが第二部会、載らない品目は第一部会であると考えれば良さそうです。
確かに、第一部会では次のように規定されていました。
(他の部会に属する事項を除く。)
したがって、上記リストに明記され、ホワイトリスト化されたものを第二部会が扱い、それ以外を第一部会が扱うという棲み分けがなされているようです。
第一、第二のネーミングから類推されるような上下格差などは全くなく、ただただ取り扱う医薬品品目というか領域が異なるのみ。たしかに、この差異を的確な名づけで分別するのは至難の業…というか不可能そうですね。序数詞による部会名称もやむなし。
近年の異動
実は上記リストは固定的なモノではなく、所掌範囲の見直しの結果、現在の形になったようです。
2001年の省庁再編で薬食審および薬事分科会が現在の形になりましたが、およそ10年後、「第一部会」においてのみ新薬の審査品目数が増加し審査対象医薬品各々の審査時間が短縮されてしまう、十分な審議期間を取れない問題が指摘されました。
その結果、2010年には取扱品目数の「第一」「第二」格差是正が行われています。
「第一部会」から「第二部会」へと移されたのは、呼吸器官用薬、外用を除くアレルギー用薬、感覚器官用薬(炎症性疾患)や、一部の体内診断薬と放射性医薬品。
一応、これまで「第二部会」で扱っていた品目に関係の近いものが選ばれたようです。
参照:薬食審医薬品第一・第二両部会の見直しに期待:薬事日報(2010年8月4日 (水))
参照:薬事分科会規定を改正‐第一、二部会の品目平準化:薬事日報(2010年10月5日 (火))
利益相反
一時期、両部会を含む薬事分科会所属部会の参加者が、審議品目を取り扱う営利企業から金品を受け取ってそれを過少申告したり、企業関係者であることを黙っていたことが問題となりました。
この問題は、厚生労働省の医薬・生活衛生局が実施する検討会として下記の委員会で議論されています。
医薬品承認に関わる審議会参加者が利益相反的にクリーンか否かを評価する…という性悪説に則るしかない状況に追いやられてしまいました。当委員会では熱い議事を楽しむことが出来ます。
開催日程、議事録等
薬事分科会の開催日程は厚生労働省のウェブサイトに掲示され、随時更新されています。
議事録の内容まで読み込みたい方は以下もご参照ください。
詳細は議事録を参照
厚生労働省に設置された各審議会、各分科会、各部会の審議内容に関しては、規程により議事録作成が義務付けられ、その多くは厚労省ウェブサイト上で公開されています。
しかしながら、ワープロソフトの文章をそのままHTML(インターネット表示用のフォーマット)出力したような読みづらさを拭うことができません。


